Toàn bộ nội dung
“Có nên loại bỏ HA khỏi các sản phẩm chăm sóc da?”
Câu hỏi này đang đại diện cho một làn sóng tranh cãi sôi nổi trong cộng đồng làm đẹp gần đây. Mỗi ngày, hàng triệu người tiêu dùng trên khắp thế giới lựa chọn sản phẩm chăm sóc da chứa Hyaluronic acid (HA), tin rằng nó sẽ giữ cho làn da của họ căng mịn và tươi trẻ.
Tuy nhiên, trong thời gian gần đây, một số nghiên cứu và ý kiến từ chuyên gia lại đặt ra câu hỏi ngược lại về khả năng HA gây ra các phản ứng viêm trên da. Với một cộng đồng tiêu dùng đã bị ám thị quá nhiều bởi những từ khóa “kháng viêm”, “kiềm viêm”, “hạn chế viêm”, tin đồn HA gây viêm đã khiến cho cuộc tranh luận này trở nên gay gắt hơn bao giờ hết.
Từ những buổi trò chuyện ở quầy mỹ phẩm đến những diễn đàn trực tuyến, các tín đồ yêu da đang cố gắng giải mã sự mâu thuẫn giữa lợi ích tưởng chừng như vô cùng của HA và nỗi lo lắng về nguy cơ gây viêm tiềm ẩn. Câu chuyện này không chỉ là về việc làm đẹp, mà còn về sức khỏe và niềm tin. Nhiều người sợ rằng việc sử dụng HA có thể làm cho tình trạng da trở nên tồi tệ hơn, trong khi các nhà sản xuất và nhà nghiên cứu vẫn kiên quyết khẳng định rằng HA là một nguyên liệu chăm sóc da an toàn và hiệu quả.
Thế nhưng câu hỏi vẫn còn đó: liệu HA có nên thực sự là “con ghẻ” trong giới skincare, hay chuyện HA gây viêm chỉ là một phần trong một bức tranh lớn hơn, cần phải được hiểu rõ hơn?
Các dẫn chứng, số liệu và phân tích trong bài viết này sẽ làm sáng tỏ về vai trò quan trọng của HA trong các quá trình sinh lý của da, cũng khám phá gốc rễ của mối liên hệ giữa HA và phản ứng viêm của da, giúp bạn hiểu rõ hơn về tính chất của phản ứng viêm và liệu nó có đem lại lợi ích cho làn da hay không.
Sơ lược về Hyaluronic Acid
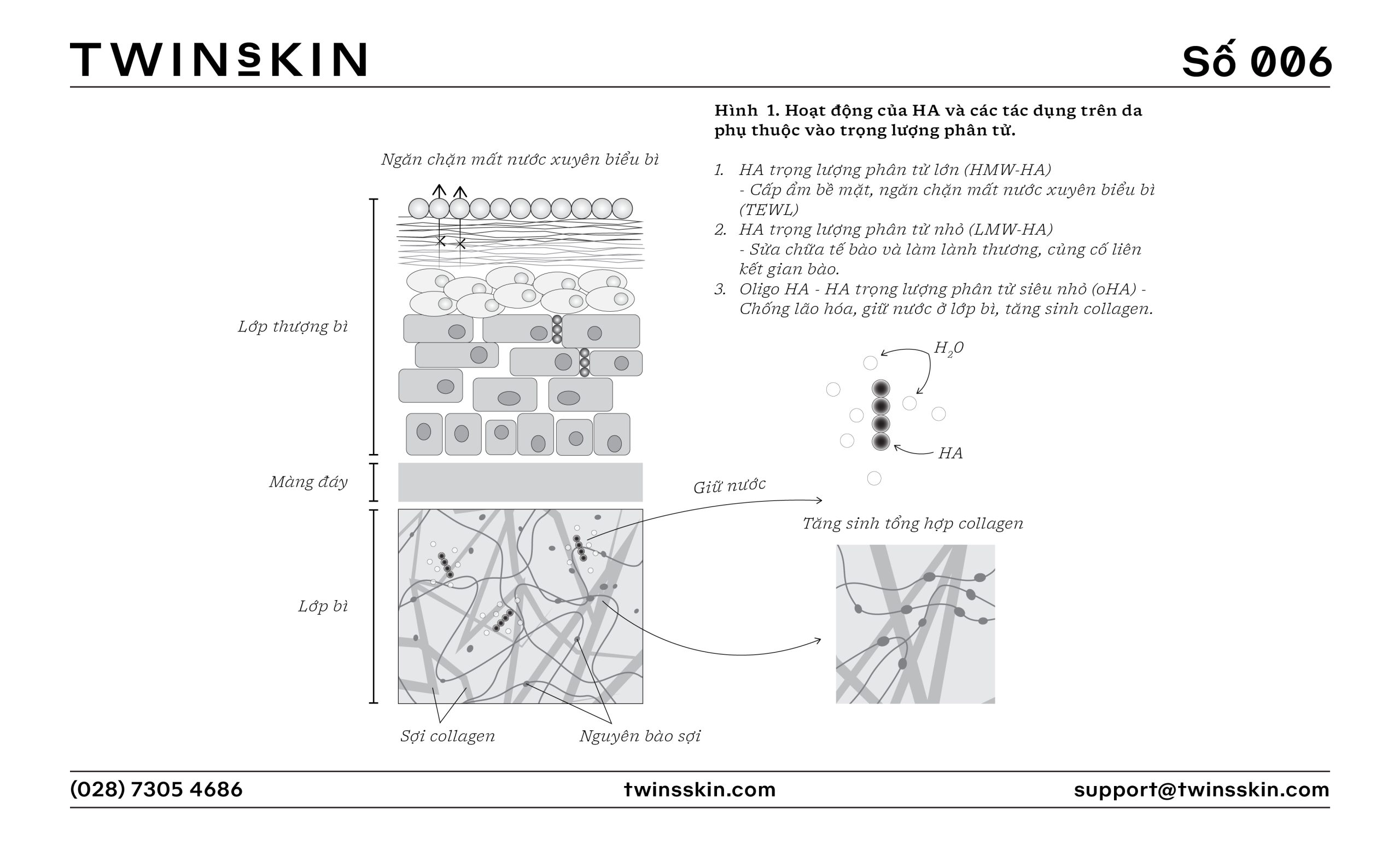
Hyaluronic Acid (HA) – một loại glycosaminoglycan (GAG), là một phần quan trọng của mô liên kết, mô sụn và mô da. HA có khả năng giữ nước đặc biệt cao, giúp duy trì độ ẩm và độ đàn hồi của da. Trong nghiên cứu và ứng dụng y học, các dạng HA khác nhau được sử dụng rộng rãi trong điều trị các bệnh lý về da, viêm khớp, và làm đẹp. Tuy nhiên, hiệu quả và cách thức sử dụng của chúng phụ thuộc vào mục tiêu cụ thể và cần được cân nhắc kỹ lưỡng.
HA có thể được phân loại dựa trên trọng lượng phân tử, và việc chia nhóm này có thể thay đổi tùy trường hợp. Trong nghiên cứu khoa học, HA thường được phân loại dựa vào kích thước phân tử của nó thành ba dạng chính: HA trọng lượng phân tử lớn (HMW-HA), HA trọng lượng phân tử nhỏ (LMW-HA), và oligo-HA (oHA).
- HMW-HA có trọng lượng phân tử trên 1000 kDa và được biết đến với khả năng duy trì độ ẩm và độ đàn hồi trên bề mặt da. Nó cũng giúp tạo ra một hàng rào tự nhiên bảo vệ da khỏi các tác nhân gây hại từ môi trường. Trong dịch khớp, HMW-HA làm tăng độ nhớt, giúp giảm ma sát giữa các sụn và hỗ trợ chức năng vận động mượt mà.
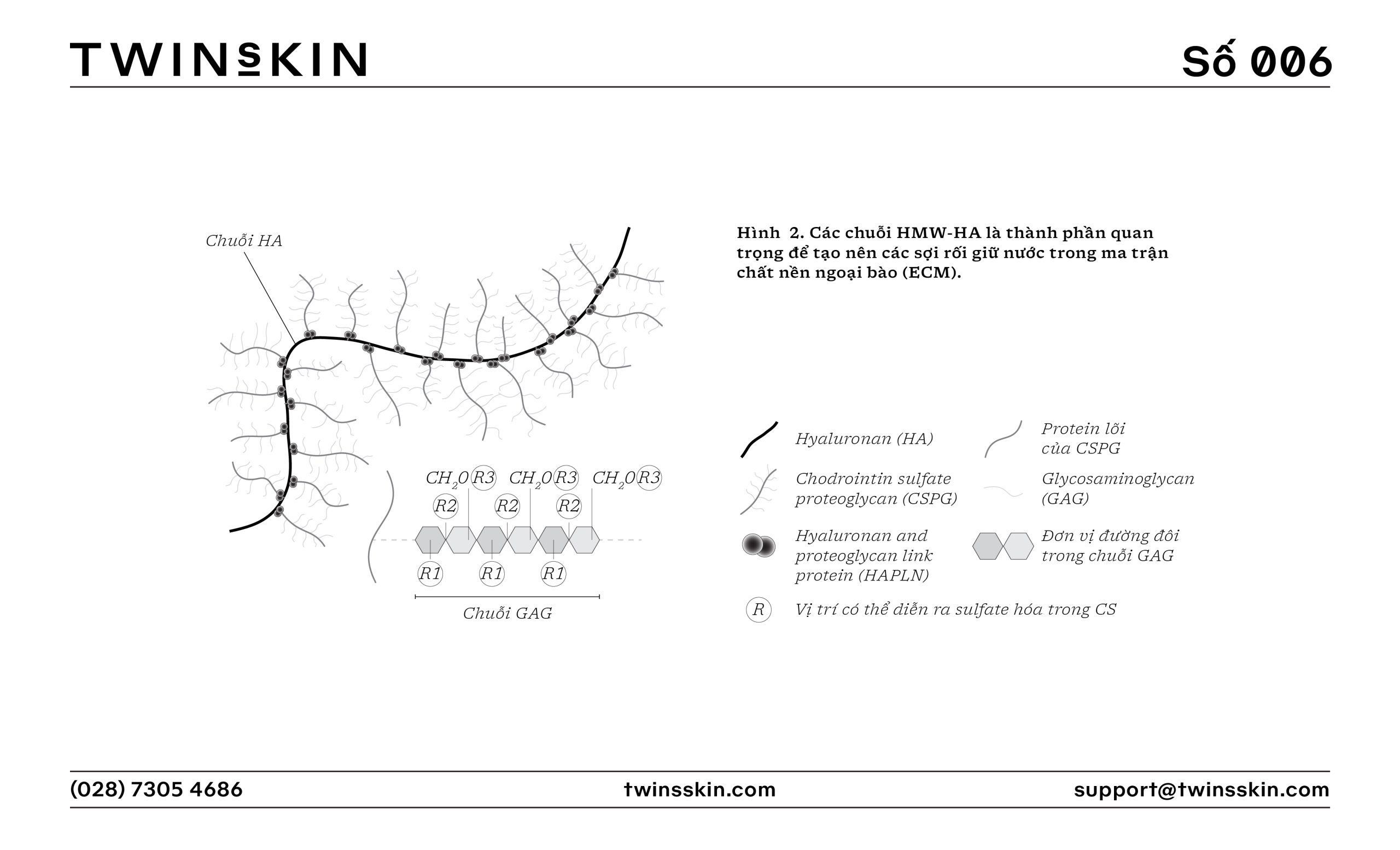
- LMW-HA có trọng lượng phân tử dưới 1.000 kDa và thậm chí có thể xuống đến vài chục kDa. Do kích thước phân tử nhỏ, LMW-HA có khả năng xâm nhập sâu vào các lớp da, hỗ trợ quá trình tái tạo da từ bên trong. LMW-HA cũng tham gia vào các quá trình chống viêm và phục hồi mô, nhưng ở một số điều kiện nhất định, nó có thể kích thích phản ứng viêm.
- oHA là các đoạn phân tử cực ngắn của HA, có kích thước dưới 10 kDa. oHA có khả năng thúc đẩy quá trình tái tạo tế bào và chữa lành vết thương, đồng thời có thể kích thích sản xuất HA tự nhiên trong cơ thể. Do kích thước nhỏ, oHA có khả năng thâm nhập sâu vào da và tác động đến các tế bào ở mức độ tế bào và phân tử.
Ngoài ra, các nhà cung cấp nguyên liệu lại thường chia HA thành 4 nhóm, bao gồm: HA trọng lượng phân tử lớn (1500 – 1800 kDa), HA trọng lượng phân tử vừa (800 – 1400 kDa), HA trọng lượng phân tử nhỏ (200 – 500 kDa) và oligo-HA (từ 10 kDa trở xuống).
Bản chất của phản ứng viêm: Phân biệt “viêm tốt” và “viêm xấu”
Phản ứng viêm là gì
Phản ứng viêm là một phần thiết yếu của hệ thống miễn dịch, giúp bảo vệ cơ thể chống lại các tác nhân gây hại như nhiễm trùng và chấn thương. Mục tiêu chính của phản ứng viêm là loại bỏ nguyên nhân gây hại và khởi đầu quá trình phục hồi mô. Tuy nhiên, viêm cũng có thể đóng một vai trò trong nhiều bệnh lý mãn tính.

Viêm có thể được phân loại thành hai loại chính: viêm cấp tính, thường nhanh chóng và mạnh mẽ, và viêm mãn tính, có thể diễn ra âm ỉ và kéo dài. Một chu trình viêm điển hình có thể được tóm tắt thành các bước như sau:
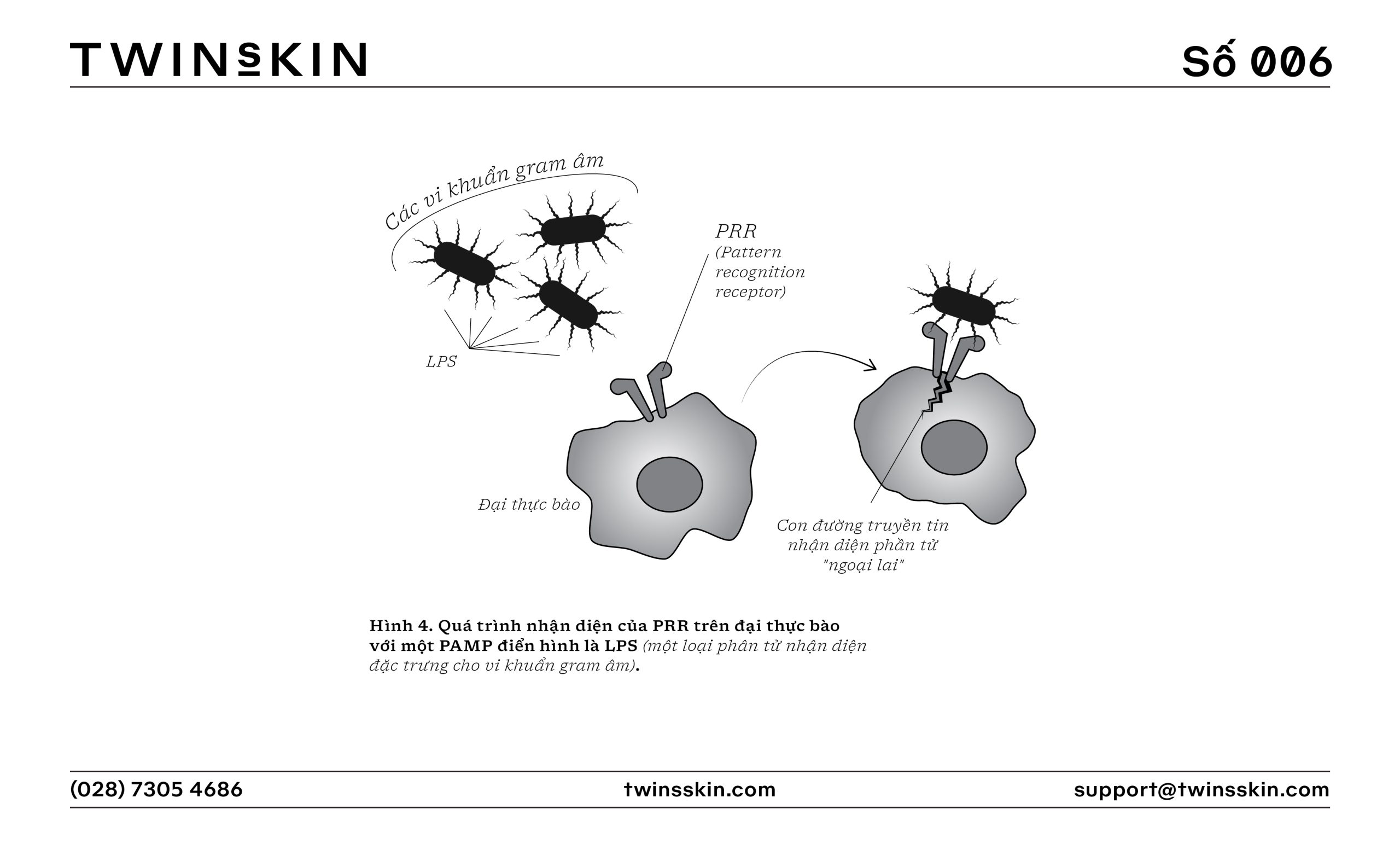
Cảm ứng ban đầu và Phát hiện tác nhân gây hại
-
- Nhận diện mẫu bằng các PRR (Pattern recognition receptor – Thụ thể nhận dạng khuôn mẫu, có vai trò xác định một hay nhiều nhóm phân tử sở hữu một điểm chung nào đó): Các tế bào miễn dịch tại chỗ (có thể là các đại thực bào, tế bào tua, bạch cầu đơn nhân và tế bào lympho B) sử dụng PRR để nhận diện các PAMP (Pathogen-associated molecular pattern – mô hình phân tử liên quan đến tác nhân gây bệnh, là một nhóm các phân tử đặc trưng chỉ có trên các đối tượng gây bệnh, không có ở tế bào chủ) và các DAMP (Damage-associated molecular pattern – mô hình phân tử liên quan đến tổn thương, là một nhóm các phân tử đặc trưng được giải phóng bởi các tế bào chết hoặc bị tổn thương). Các thụ thể giống Toll (TLR – Toll-like receptor) và thụ thể giống NOD (NLR – NOD-like receptor) là ví dụ điển hình về các PRR tham gia vào việc kích hoạt phản ứng viêm.
-
- Kích hoạt yếu tố hạt nhân kappa B (NF-κB): Khi PRR được kích hoạt bởi PAMP hoặc DAMP, điều này dẫn đến việc kích hoạt con đường tín hiệu NF-κB, một yếu tố chuyển vị quan trọng trong việc sản xuất các cytokine viêm.
Thu hút và kích hoạt tế bào miễn dịch
-
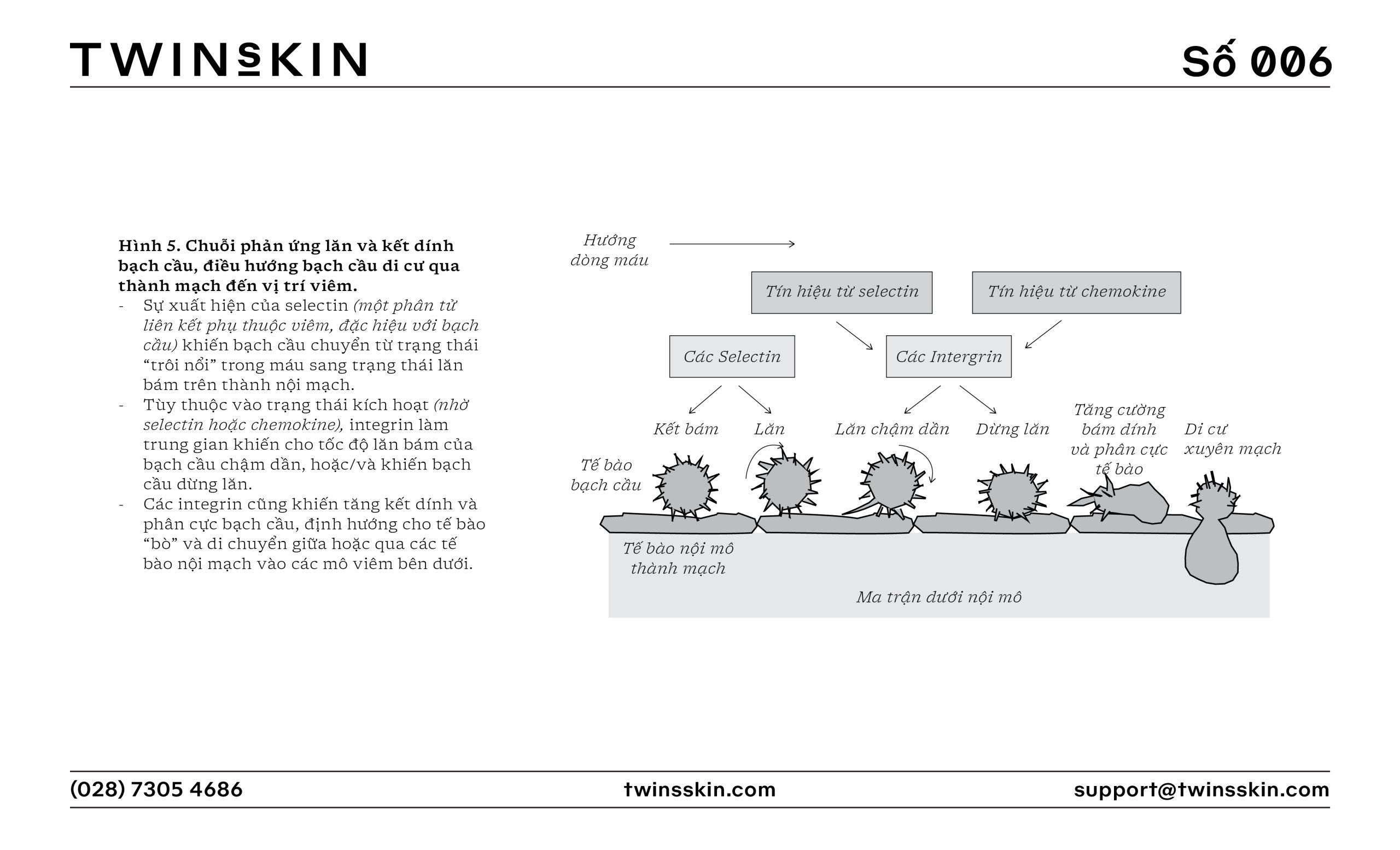
- Sản xuất chemokine và cytokine: Các tế bào đã kích hoạt tiết ra các chemokine (như CCL2) và cytokine (như IL-1β, TNF-α). Cytokine và chemokine góp phần thu hút thêm các tế bào miễn dịch từ mạch máu, như bạch cầu trung tính và bạch cầu đơn nhân, đến khu vực bị tổn thương.
- Sự lăn và kết dính của các tế bào bạch cầu: Tế bào bạch cầu tương tác với các phân tử chọn lọc trên thành mạch máu thông qua quá trình lăn, sau đó bám chắc vào thành mạch thông qua các phân tử bám dính như ICAM-1, và từ từ “luồn lách” ra khỏi mạch máu để đến vị trí viêm.
Sự xuyên mạch và thực bào
-
- Di cư qua thành mạch: Các tế bào miễn dịch di chuyển qua thành mạch máu và vào khu vực bị tổn thương thông qua quá trình xuyên mạch (diapedesis), được hỗ trợ bởi sự tăng tính thấm của mạch máu và sự giãn mạch (vasodilation) do tác động của các cytokine.
- Sự thực bào: Các bạch cầu trung tính và đại thực bào tiêu diệt các tác nhân gây hại hoặc dọn dẹp các tế bào chết thông qua quá trình thực bào (phagocytosis). Các enzyme thủy phân trong lysosome (một loại bào quan chuyên dùng trong thực bào nhờ các phản ứng thủy phân), và các hợp chất có tính oxy hóa cao giúp diệt vi khuẩn và virus bên trong thể thực bào sinh tan (phagolysosome).
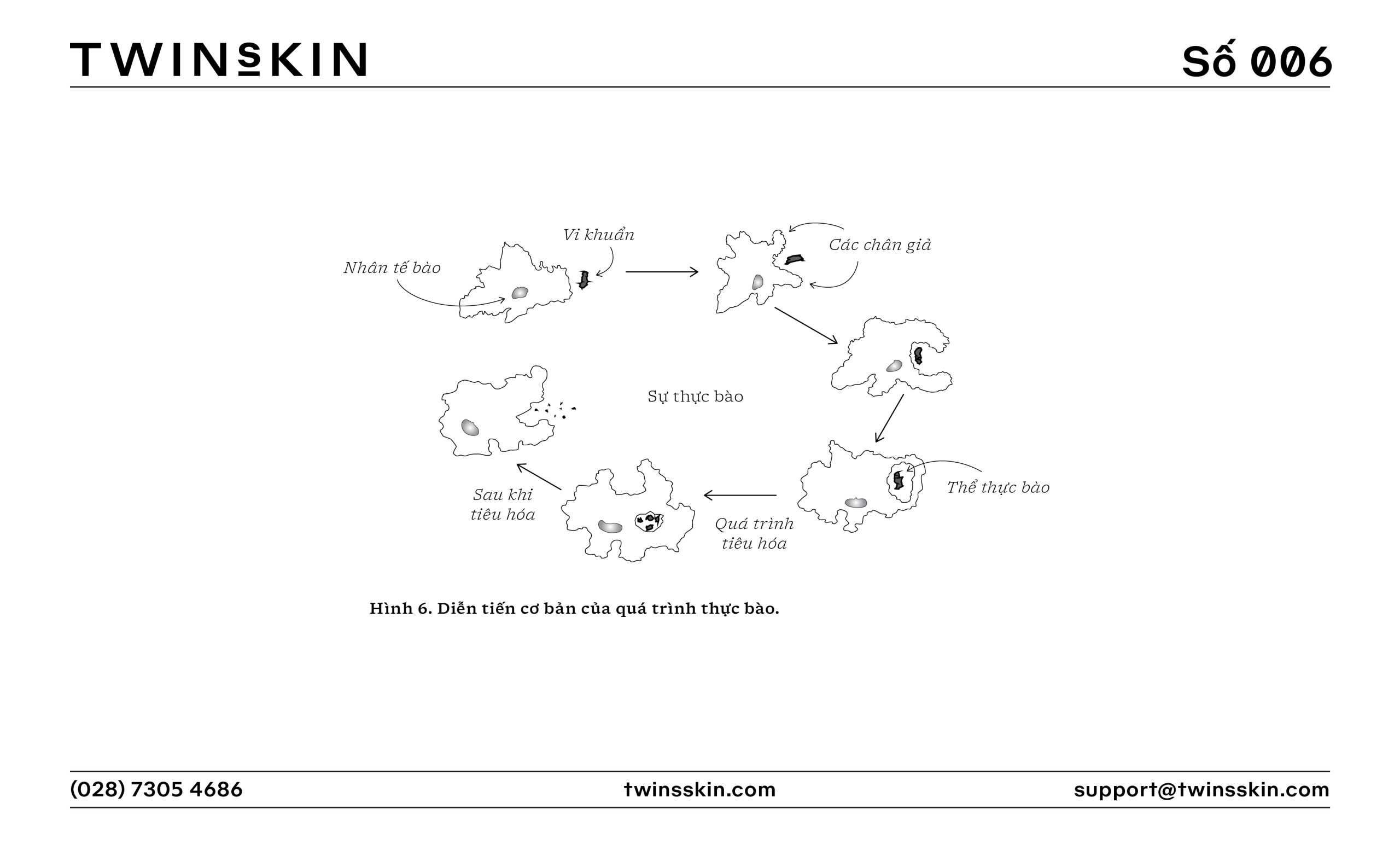
Giải quyết viêm và sửa chữa mô
-
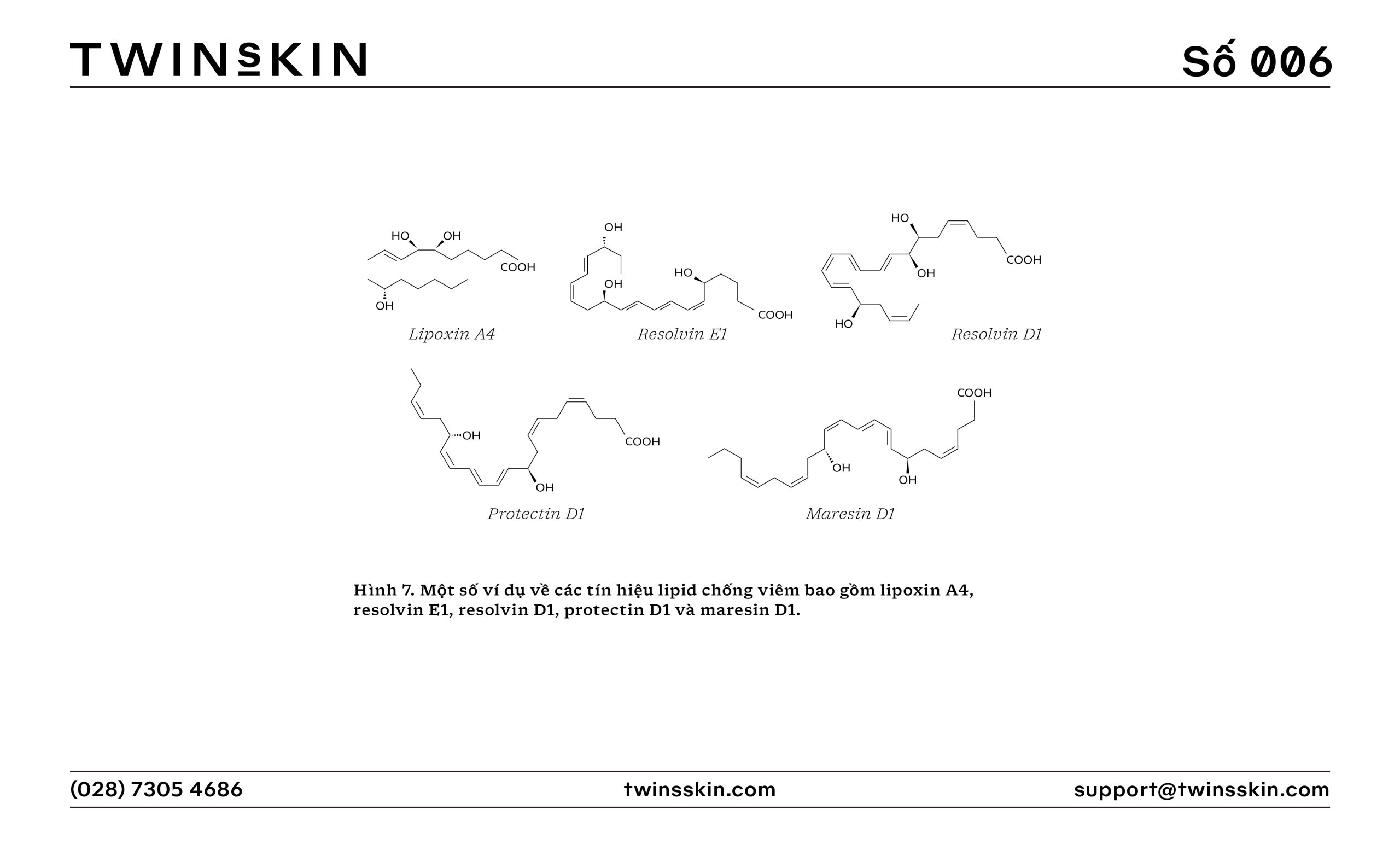
- Các tín hiệu giải quyết viêm: Lipoxin, resolvin, và protectin là các tín hiệu lipid chống viêm thúc đẩy việc giải quyết viêm, giảm tập trung bạch cầu và kích thích tái tạo mô.
-
- Sửa chữa mô: Nguyên bào sợi sản xuất các thành phần chất nền ngoại bào mới, bao gồm các GAG (như hyaluronic acid, proteoglycan), collagen, elastin… để thúc đẩy sự sửa chữa mô và hình thành sẹo.
Có thể tóm tắt lại quá trình viêm thành một câu chuyện về cuộc phiêu lưu của các “anh hùng” tế bào trong cơ thể
-
- Trong thị trấn Tế Bào, các cảnh sát tinh nhuệ, những thám tử thụ thể PRR luôn trực chiến. Khi những kẻ xâm nhập như PAMP và DAMP xuất hiện, chúng nhanh chóng phát hiện và kích hoạt còi báo động, NF-κB, báo cho cả thị trấn biết một cuộc tấn công đang diễn ra.
- Trạm chỉ huy Đại thực bào, nơi sản xuất các tín hiệu báo động như chemokine và cytokine, vang lên tiếng còi kêu gọi các chiến binh miễn dịch. Những siêu chiến binh đến từ Hệ bạch huyết xa xôi như Bạch cầu Trung tính và Bạch cầu Đơn nhân lập tức tập kết, sẵn sàng chiến đấu, di chuyển nhanh chóng trên các con đường giao thông của mạch máu để tiến đến tiền tuyến. Nhờ sự chỉ dẫn của các chú bé chỉ đường ICAM-1, selectin và integrin, các chiến binh bạch cầu đã âm thầm hành quân đến thẳng vị trí địch đóng quân.
- Đến nơi, các siêu chiến binh đột kích vào ổ viêm thông qua sự mở cổng của các đồng chí thành mạch – quá trình xuyên mạch. Trong trận chiến cuồng nộ, họ không chỉ đối đầu với các kẻ xâm nhập mà còn dọn dẹp chiến trường bằng cách thực bào, nơi họ bắt cóc kẻ xâm nhập và “nghiền nát” chúng trong các túi thực bào.
- Sau trận chiến, đã đến lúc xây dựng lại thị trấn. Các kiến trúc sư Nguyên bào sợi tiến hành xây dựng lại cơ sở hạ tầng bị hư hại, sản xuất nên chất nền ngoại bào mới. Trong khi đó, các dịch vụ dọn dẹp như lipoxin và resolvin giúp quét sạch bụi bặm chiến tranh, khôi phục trật tự và bình yên cho thị trấn.
Qua cuộc phiêu lưu này, chúng ta thấy rằng mỗi nhân vật và sự kiện trong câu chuyện viêm đều đóng vai trò quan trọng trong việc bảo vệ và phục hồi cơ thể sau sự xâm lăng của các tác nhân gây hại.
“Viêm tốt” và “Viêm xấu”: Cái gì quá cũng không tốt
Viêm cấp tính aka. “viêm tốt”: Phản ứng viêm cần thiết
Viêm cấp tính bắt đầu như một phản ứng nhanh chóng của cơ thể đối với sự xâm nhập của mầm bệnh hoặc tổn thương. Tế bào chủ yếu tham gia vào giai đoạn này là các đại thực bào và các tế bào bạch cầu trung tính, chúng được thu hút bởi các phân tử “tiếng gọi trợ giúp” như các cytokine và chemokine được giải phóng từ tế bào bị tổn thương hoặc nhiễm trùng.
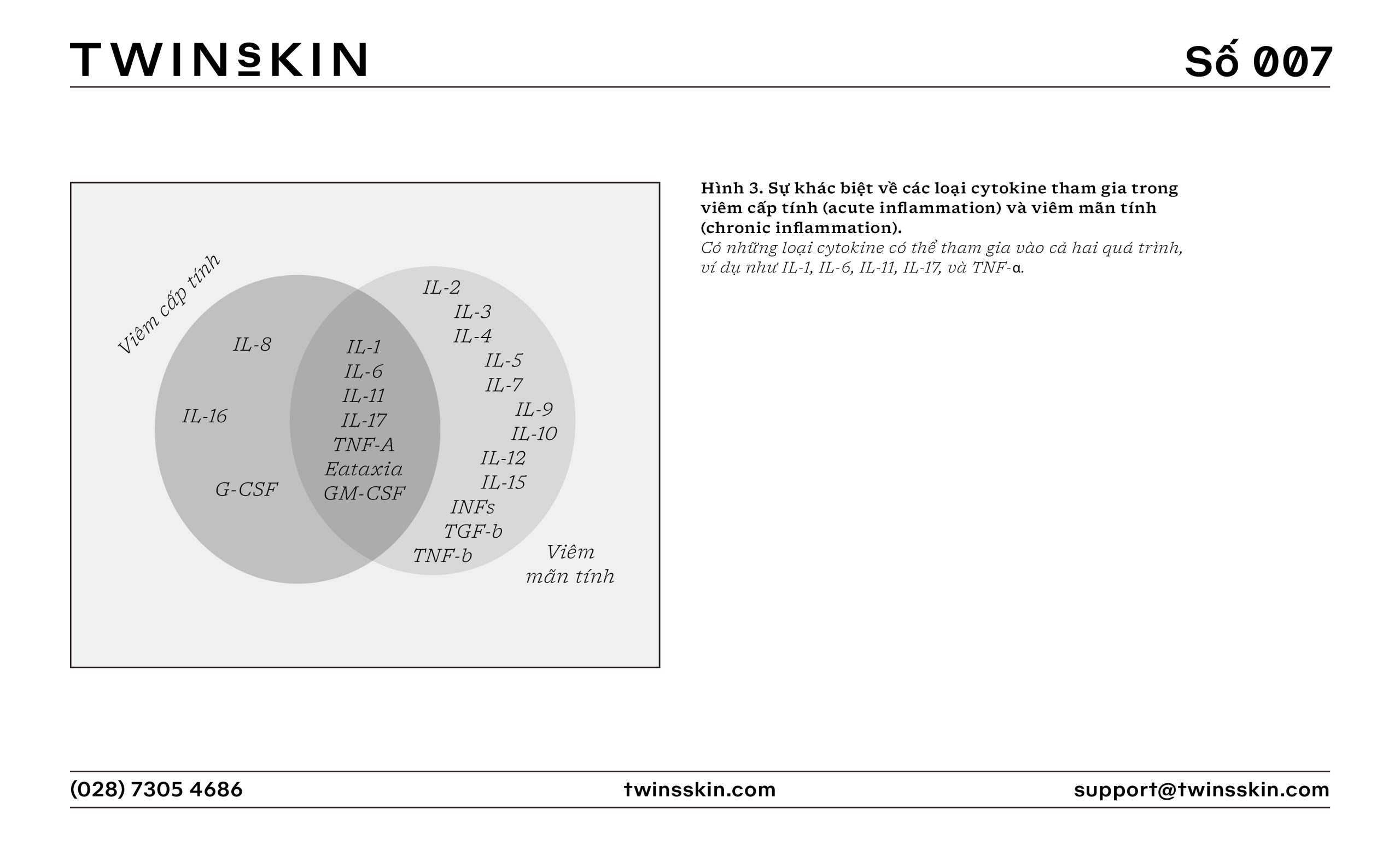
Các phân tử như interleukin-1 (IL-1), interleukin-6 (IL-6), và yếu tố hoại tử khối u alpha (TNF-α) đóng vai trò chính trong việc kích hoạt và điều tiết phản ứng viêm. Chúng thúc đẩy việc tăng sản xuất và giải phóng các phân tử bám dính và chemokine, từ đó làm tăng khả năng di chuyển của các tế bào miễn dịch đến khu vực bị tổn thương.
Một trong những cơ chế quan trọng nhất trong viêm cấp tính là quá trình thực bào, nơi các bạch cầu trung tính và các tế bào miễn dịch khác tiêu diệt các mầm bệnh và tế bào hỏng. Các tế bào này cũng giải phóng các enzyme và các chất oxy hóa mạnh để tiêu diệt vi khuẩn và loại bỏ tế bào chết, nhưng quá trình này cũng có thể gây hại cho mô lành xung quanh nếu không được kiểm soát.
Bên cạnh đó, “viêm tốt” còn có thể được hiểu là những tổn thương vi điểm, kích thích phản ứng viêm cấp tính cục bộ, nhưng không gây stress tổn thương và stress oxy hóa quá mức cho cơ thể, cộng với thời gian lành thương ngắn và khả năng lành thương cao.
Viêm mãn tính aka. “viêm xấu”: Viêm dài, viêm dai trở nên viêm “dại”
Viêm mãn tính xảy ra khi phản ứng viêm không được giải quyết hoàn toàn, dẫn đến tình trạng viêm kéo dài, liên tục, thường gây tổn thương mô và phá hủy cấu trúc mô. Ở giai đoạn này, các tế bào miễn dịch như tế bào lympho và đại thực bào sẽ “làm chủ cuộc chơi”, sản xuất liên tục các cytokine gây viêm như TNF-α, IL-1β, và IL-6.
Sự gia tăng của các cytokine này không chỉ tăng cường phản ứng viêm mà còn gây tổn thương tế bào và mô, làm tăng nguy cơ phát triển các tình trạng bệnh lý như viêm da dị ứng, trứng cá đỏ và các rối loạn tự miễn như bệnh vảy nến.

Một yếu tố chính trong viêm mãn tính là sự kích hoạt không kiểm soát của NF-kB có thể dẫn đến sản xuất quá mức các cytokine gây viêm, góp phần vào quá trình viêm mãn tính và tổn thương mô kéo dài.
Viêm mãn tính cũng liên quan đến sự tăng cường stress oxy hóa, nơi các gốc (ROS) và các chất oxy hóa khác được sản xuất quá mức, gây hại cho tế bào và mô. Stress oxy hóa không chỉ gây tổn thương DNA, protein và màng tế bào, mà còn kích thích thêm viêm, tạo thành một vòng luẩn quẩn của viêm và tái viêm.
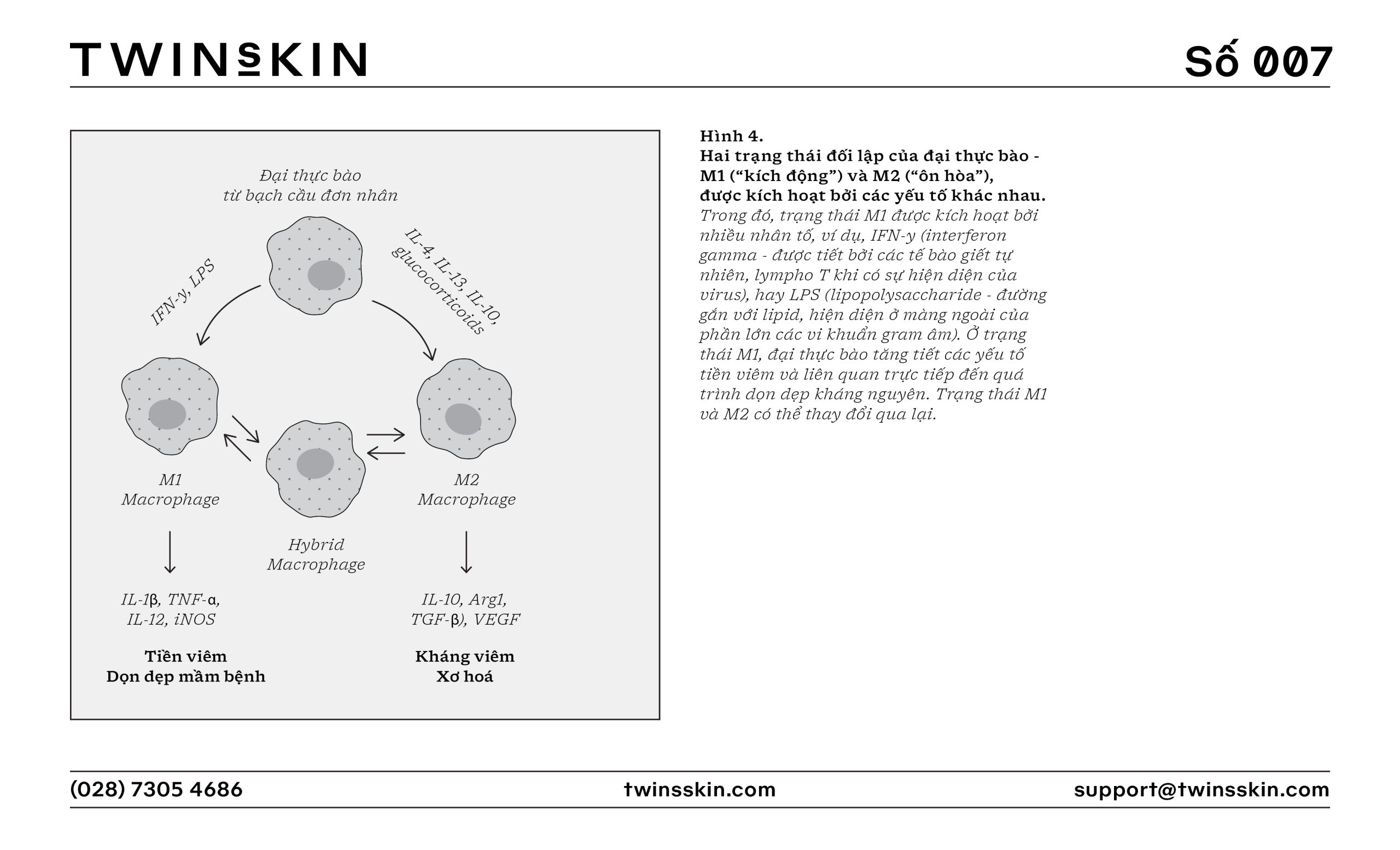
Trong viêm mãn tính, quá trình chuyển hóa các đại thực bào cũng thay đổi, khiến chúng liên tục trở nên “kích động” ở trạng thái M1, giải phóng các chất gây viêm và enzyme tiêu hóa vào mô xung quanh, trong nỗ lực giải quyết nguyên nhân gây viêm. Điều này góp phần khiến chu trình viêm không dứt và tổn thương mô liên tục, thậm chí khi tác nhân ban đầu gây viêm đã được loại bỏ.
Có một cách hiểu khác về “viêm xấu”, chính là những tổn thương nghiêm trọng, trên diện rộng, gây stress tổn thương và stress oxy hóa một cách ồ ạt trong thời gian ngắn, cộng với thời gian lành thương kéo dài và khả năng lành thương thấp.
[Còn tiếp] Vậy là kết thúc phần 1 rồi. Trong phần đầu của bài viết, chúng ta đã khám phá sơ lược về HA – một thành phần không thể thiếu trong lĩnh vực chăm sóc da, nhờ khả năng giữ ẩm vượt trội và hỗ trợ hàng rào bảo vệ da. Bên cạnh đó, chúng ta cũng đã đi sâu vào bản chất của phản ứng viêm và diễn tiến của một quá trình viêm điển hình, phân biệt như thế nào là “viêm tốt”, “viêm xấu”.
Ở phần tiếp theo, chúng ta sẽ tập trung vào một chủ đề đầy thách thức nhưng không kém phần thú vị: Sự tương tác của HA với tế bào ở cấp độ phân tử, làm rõ được vai trò của các dạng thức HA khác nhau trong đáp ứng miễn dịch, cũng như tiếp tục bàn luận về chủ đề HA gây viêm ở khía cạnh thực tế lâm sàng, giải pháp ngăn ngừa HA gây viêm ở nhiều góc độ và đưa ra kết luận cuối cùng rằng, phải chăng HA có thực sự gây viêm hay không.
Tài liệu tham khảo
- Papakonstantinou, E., Roth, M., & Karakiulakis, G. (2012). Hyaluronic acid: A key molecule in skin aging. Dermato-Endocrinology, 4(3), 253-258.
- Necas, J., Bartosikova, L., Brauner, P., & Kolar, J. (2008). Hyaluronic acid (hyaluronan): a review. Veterinarni Medicina, 53(8), 397-411.
- Medzhitov, R. (2008). Origin and physiological roles of inflammation. Nature, 454(7203), 428-435.
- Nathan, C. (2002). Points of control in inflammation. Nature, 420(6917), 846-852.
- Serhan, C. N., & Savill, J. (2005). Resolution of inflammation: the beginning programs the end. Nature Immunology, 6(12), 1191-1197.
- Kubo, T., Morita, H., Sugita, K., & Akdiş, C. A. (2017). Introduction to mechanisms of allergic diseases. In Elsevier eBooks (pp. 1–27).
- Nam D. Đ. B. S. T. V. (2019, November 19). [Miễn dịch] Làm thế nào mà những lính canh của hệ miễn dịch nhận diện được giặc ngoại xâm! Y Khoa.
- Lawrence, T. (2009). The nuclear factor NF-kappaB pathway in inflammation. Cold Spring Harbor Perspectives in Biology, 1(6), a001651.
- Mantovani, A., Sica, A., Sozzani, S., Allavena, P., Vecchi, A., & Locati, M. (2004). The chemokine system in diverse forms of macrophage activation and polarization. Trends in Immunology, 25(12), 677-686.
- Nathan, C. (2006). Neutrophils and immunity: challenges and opportunities. Nature Reviews Immunology, 6(3), 173-182.
- Serhan, C. N. (2014). Pro-resolving lipid mediators are leads for resolution physiology. Nature, 510(7503), 92-101.
- Libby, P. (2007). Inflammatory mechanisms: The molecular basis of inflammation and disease. Nutrition Reviews, 65(12 Pt 2), S140-6.
- Nathan, C., & Ding, A. (2010). Nonresolving inflammation. Cell, 140(6), 871-882.
- Reuter, S., Gupta, S. C., Chaturvedi, M. M., & Aggarwal, B. B. (2010). Oxidative stress, inflammation, and cancer: How are they linked? Free Radical Biology and Medicine, 49(11), 1603-1616.
- McEver, R. P., & Zhu, C. (2010). Rolling cell adhesion. Annual review of cell and developmental biology, 26, 363–396.
- Da Cruz Nizer, W. S., Inkovskiy, V., & Overhage, J. M. (2020). Surviving reactive chlorine stress: Responses of Gram-Negative bacteria to hypochlorous acid. Microorganisms, 8(8), 1220.
- Lierova, A., Kasparova, J., Filipova, A., Cizkova, J., Pekarova, L., Korecka, L., Mannova, N., Bilkova, Z., & Sinkorova, Z. (2022). Hyaluronic Acid: Known for Almost a Century, but Still in Vogue. Pharmaceutics, 14(4), 838.
- Fallacara, A., Baldini, E., Manfredini, S., & Vertuani, S. (2018). Hyaluronic acid in the third millennium. Polymers, 10(7), 701.
- Cyphert, J. M., Trempus, C. S., & Garantziotis, S. (2015). Size matters: molecular weight specificity of hyaluronan effects in cell biology. International journal of cell biology, 2015.
- Juncan, A. M., Moisă, D. G., Santini, A., Morgovan, C., Rus, L. L., Vonica-Țincu, A. L., & Loghin, F. (2021). Advantages of hyaluronic acid and its combination with other bioactive ingredients in cosmeceuticals. Molecules, 26(15), 4429.
- Cooper, C. A., Brown, K. K., Meletis, C. D., & Zabriskie, N. (2008). Inflammation and hyaluronic acid. Alternative & complementary therapies, 14(2), 78-84.
- Lee, B. M., Park, S. J., Noh, I., & Kim, C. H. (2021). The effects of the molecular weights of hyaluronic acid on the immune responses. Biomaterials Research, 25(1), 27.
- Trung, V. T. (2020). Da liễu cơ bản. Bộ môn Da liễu, Đại học Y Dược Thành phố Hồ Chí Minh.
- Smejkalova, D., Huerta-Angeles, G., Ehlova, T., & Dobrouc, D. (2015). Hyaluronan (Hyaluronic Acid): a natural moisturizer for skin care. Harry’s 9th Edition, 2, 605-622.
- Esser, P. R., Wölfle, U., Dürr, C., von Loewenich, F. D., Schempp, C. M., Freudenberg, M. A., … & Martin, S. F. (2012). Contact sensitizers induce skin inflammation via ROS production and hyaluronic acid degradation. PloS one, 7(7), e41340.
- Zhu, J., Tang, X., Jia, Y., Ho, C. T., & Huang, Q. (2020). Applications and delivery mechanisms of hyaluronic acid used for topical/transdermal delivery–a review. International journal of pharmaceutics, 578, 119127.
- Hiramoto, K., Kobayashi, H., Yamate, Y., Ishii, M., & Sato, E. F. (2012). Intercellular pathway through hyaluronic acid in UVB-induced inflammation. Experimental Dermatology, 21(12), 911–914.
- Byun, S., Chae, J., Na, J. I., & Park, K. (2016). Significant improvement in crow’s feet after treatment with Jet-M and a mixed solution of copper–GHK, oligo-hyaluronic acid, rhodiolar extract, tranexamic acid, and β-glucan (GHR formulation). Journal of Cosmetic and Laser Therapy, 18(5), 293–295.
- Kotla, N. G., Bonam, S. R., Rasala, S., Wankar, J., Bohara, R. A., Bayry, J., Rochev, Y., & Pandit, A. (2021). Recent advances and prospects of hyaluronan as a multifunctional therapeutic system. Journal of Controlled Release, 336, 598–620.
- Campo, G. M., Avenoso, A., Campo, S., D’Ascola, A., Nastasi, G., & Calatroni, A. (2010). Molecular size hyaluronan differently modulates toll-like receptor-4 in LPS-induced inflammation in mouse chondrocytes. Biochimie (Print), 92(2), 204–215.
- Turley, E. A., Wood, D. K., & McCarthy, J. B. (2010). Carcinoma cell hyaluronan as a “portable” cancerized prometastatic microenvironment. Cancer Research, 70(9), 3381-3384.
- Smith, J. G. (2007). The role of hyaluronic acid in wound healing: assessment of clinical evidence. American Journal of Clinical Dermatology, 8(6), 347-354.
- Lupton, J. R., & Alster, T. S. (2000). Cutaneous hypersensitivity reaction to injectable hyaluronic acid gel. Dermatologic Surgery, 26(2), 135–137.
- Petrey, A. C., & de la Motte, C. A. (2014). Hyaluronan, a crucial regulator of inflammation. Frontiers in Immunology, 5, 101.
- Feghali, C. A., & Wright, T. M. (1997). Cytokines in acute and chronic inflammation. Frontiers in bioscience: a journal and virtual library, 2, d12–d26.